Google DeepSomatic: nowa AI do precyzyjnego tropienia genetycznych przyczyn raka
Naukowcy z Google zaprezentowali nowe narzędzie oparte na sztucznej inteligencji, nazwane DeepSomatic.
To już kolejny w ostatnim czasie pozytywny przykład wykorzystania zaawansowanych modeli AI w naukach medycznych. Jak informowaliśmy niedawno, inny model Google – C2S-Scale – pomógł naukowcom z Yale odkryć potencjalnie nową ścieżkę leczenia raka.
DeepSomatic skupia się na równie krytycznym, a może nawet wcześniejszym etapie: fundamentalnej diagnostyce i zrozumieniu, co napędza nowotwór. Jego zadaniem jest precyzyjna identyfikacja mutacji genetycznych w komórkach nowotworowych, co stanowi fundament nowoczesnej medycyny onkologicznej. Model, którego szczegóły opublikowano w prestiżowym czasopiśmie „Nature Biotechnology”, jest już dostępny na zasadach open-source.
Co się popsuło?
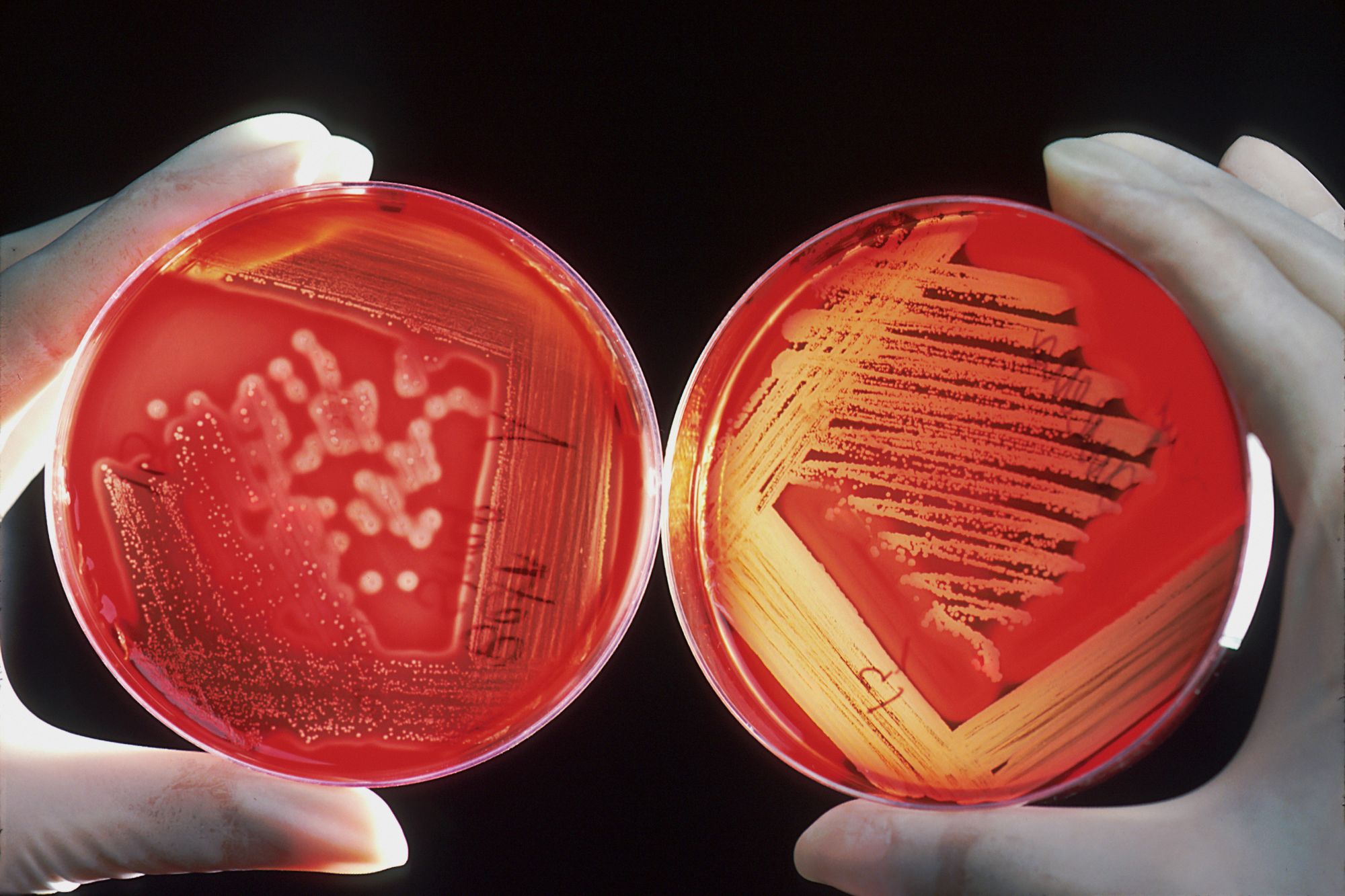
Podstawą skutecznego leczenia onkologicznego jest zrozumienie, co dokładnie „zepsuło się” w komórce i napędza niekontrolowany wzrost guza. W tym celu lekarze regularnie sekwencjonują genomy komórek nowotworowych, szukając konkretnych mutacji. Problem w tym, że proces ten jest obarczony błędami, a odróżnienie faktycznej, groźnej mutacji od zwykłego błędu odczytu (artefaktu sekwencjonowania) bywa niezwykle trudne.
Większość nowotworów jest napędzana przez tzw. warianty somatyczne – czyli mutacje nabyte w ciągu życia (np. pod wpływem promieniowania UV, czy innych czynników kancerogennych lub losowych błędów przy kopiowaniu DNA), a nie odziedziczone po rodzicach. Warianty te często występują w niewielkim odsetku komórek guza, co sprawia, że ich sygnał ginie w „szumie” generowanym przez samą maszynę do sekwencjonowania.
Dane na obraz
DeepSomatic podchodzi do tego problemu w nowatorski sposób. Zamiast analizować surowe dane tekstowe, model konwertuje dane z sekwencjonowania na obrazy. Te graficzne reprezentacje genomu są następnie analizowane przez głębokie sieci neuronowe (CNN), które zostały wytrenowane w rozpoznawaniu wizualnych wzorców charakterystycznych dla błędów oraz tych typowych dla prawdziwych mutacji. AI porównuje dane z komórek guza i komórek zdrowych pacjenta, precyzyjnie wskazując różnice. Co ważne, model potrafi działać także w trybie „tylko guz” (tumour-only), co jest kluczowe np. w przypadku białaczek, gdzie pobranie zdrowej próbki bywa niemożliwe.
Aby osiągnąć taką dokładność, Google wraz z partnerami z UC Santa Cruz Genomics Institute stworzyło referencyjny zbiór danych (benchmark CASTLE) oparty na próbkach raka piersi i płuc. W testach model AI DeepSomatic okazał się znacznie skuteczniejszy od dotychczasowych metod. W przypadku identyfikacji złożonych mutacji na popularnej platformie Illumina, AI osiągnęło wynik 90% (w skali F1-score) w porównaniu do 80% dla najlepszej konkurencyjnej metody. Na platformie Pacific Biosciences przewaga była miażdżąca: ponad 80% dla DeepSomatic wobec mniej niż 50% dla innych narzędzi.
Narzędzie udowodniło też swoją skuteczność na próbkach trudnych do analizy, np. zakonserwowanych parafiną (co uszkadza DNA) oraz pochodzących z tańszego, tzw. sekwencjonowania egzonowego. Model potrafi również stosować swoją „wiedzę” do typów nowotworów, na których nie był trenowany – z powodzeniem zidentyfikował mutacje w glejaku (agresywny rak mózgu) oraz znalazł nowe, nieznane wcześniej warianty w próbkach białaczki dziecięcej.
Wreszcie najważniejsze: Google udostępniło DeepSomatic oraz dane treningowe za darmo, licząc na przyspieszenie rozwoju medycyny precyzyjnej.
Sztuczna inteligencja na dyżurze. Czy technologia może pomóc odciążyć medyków?